유럽의약품청(EMA)이 코로나19 치료에 항바이러스제인 '렘데시비르'의 조건부 사용 승인을 권고했다.
26일 AFP, 로이터 등에 따르면 유럽의약품청 산하 기구인 약물사용자문위원회(CHMP)는 산소 공급이 필요한 폐렴 증세를 보이는 성인과 12세 이상 청소년의 코로나19 치료에 렘데시비르의 조건부 사용 승인을 권고했다고 밝혔다.
![렘데시비르]()
유럽의약품청은 "렘데시비르는 유럽연합(EU)에서 코로나19 치료에 사용 승인이 권고된 첫 번째 약물"이라고 말했다.
이번 권고는 행정부 역할을 담당하는 유럽연합 집행위원회의 승인이 필요해 다음주 안으로 결정이 이뤄질 것이라고 유럽의약품청은 설명했다.
렘데시비르는 당초 미국 제약회사 길리어드사이언스가 에볼라 치료제로 개발했으나 최근 미국에서 진행한 초기 임상시험에서 코로나19로 입원한 환자의 회복 기간을 31% 단축했다는 발표가 나오면서 주목을 받고 있다.
미국 식품의약국(FDA)은 최근 코로나19 중증 입원환자를 대상으로 한 렘데시비르의 긴급사용을 승인했다. 일본 정부도 코로나19 치료제로 렘데시비르를 제조·판매할 수 있도록 특례승인했다.
국내에서도 3일식품의약품안전처가 렘데시비르를 코로나19 치료에 사용하기로 하고 특례수입을 결정했다. [비즈니스포스트 최영찬 기자]
26일 AFP, 로이터 등에 따르면 유럽의약품청 산하 기구인 약물사용자문위원회(CHMP)는 산소 공급이 필요한 폐렴 증세를 보이는 성인과 12세 이상 청소년의 코로나19 치료에 렘데시비르의 조건부 사용 승인을 권고했다고 밝혔다.
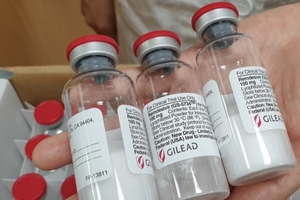
▲ 코로나19 치료제 '렘데시비르'. <연합뉴스>
유럽의약품청은 "렘데시비르는 유럽연합(EU)에서 코로나19 치료에 사용 승인이 권고된 첫 번째 약물"이라고 말했다.
이번 권고는 행정부 역할을 담당하는 유럽연합 집행위원회의 승인이 필요해 다음주 안으로 결정이 이뤄질 것이라고 유럽의약품청은 설명했다.
렘데시비르는 당초 미국 제약회사 길리어드사이언스가 에볼라 치료제로 개발했으나 최근 미국에서 진행한 초기 임상시험에서 코로나19로 입원한 환자의 회복 기간을 31% 단축했다는 발표가 나오면서 주목을 받고 있다.
미국 식품의약국(FDA)은 최근 코로나19 중증 입원환자를 대상으로 한 렘데시비르의 긴급사용을 승인했다. 일본 정부도 코로나19 치료제로 렘데시비르를 제조·판매할 수 있도록 특례승인했다.
국내에서도 3일식품의약품안전처가 렘데시비르를 코로나19 치료에 사용하기로 하고 특례수입을 결정했다. [비즈니스포스트 최영찬 기자]


![[코스피 5천 그늘①] 증시 활황에도 못 웃는 LG그룹, 구광모 '체질 개선'과 '밸류업'으로 저평가 끊나](https://businesspost.co.kr/news/photo/202602/20260209151542_142553.jpg)



![[코스피 5천 그늘②] 롯데그룹 주주 흥 돋는 카드 안 보인다, 신동빈 유통·화학 계열사 '시장 소외'에 속앓이](https://businesspost.co.kr/news/photo/202601/P_20260127151310_76677.jpg)




