[비즈니스포스트] 바이오 재생의료 전문기업 시지바이오(대표 유현승)는 자사 척추유합술용 차세대 골대체재 ‘노보시스 퍼티(NOVOSIS PUTTY)’가 지난 17일(미국 현지시각 16일) 미국 식품의약국(FDA)으로부터 IDE(임상시험계획 승인, Investigational Device Exemption)를 획득했다고 21일 밝혔다.
이번 승인으로 시지바이오는 미국 시판 허가(Premarket Approval, PMA)를 위한 마지막 임상 절차인 확증임상(Pivotal Study)을 본격적으로 돌입하게 됐으며, 미국 의료기기 시장 진출을 위한 실질적 단계를 개시하게 됐다.
![대웅 시지바이오 '노보시스 퍼티', 미국 FDA 확증임상 승인 획득]()
특히 ‘노보시스 퍼티’는 한국에서 개발된 바이오융복합 의료기기 가운데 최초로 미국 식품의약국(FDA)으로부터 확증임상 승인을 받은 사례로, 시지바이오의 글로벌 진입 전략에 있어 중대한 이정표가 될 전망이다.
IDE 승인은 의료기기를 사람을 대상으로 시험하기에 앞서, 미국 내에서 FDA의 정식 허가를 받아야 하는 절차다. 특히 골대체재와 같은 이식형 의료기기의 경우 확증임상(Pivotal Study)은 시판 허가(PMA)를 위한 필수 단계로, 미국 시장 진입을 위한 가장 높은 진입장벽 중 하나로 꼽힌다.
시지바이오는 이번 IDE 승인을 위해 철저히 준비된 비임상 및 소규모 사전 인체임상(Pilot) 결과를 기반으로 제품의 기술력과 안전성에 대한 신뢰를 확보했으며, 이를 통해 FDA의 엄격한 검증 절차를 통과했다.
‘노보시스 퍼티’는 2023년 12월 FDA로부터 혁신의료기기(Breakthrough Device)로 지정되면서 이미 글로벌 수준의 차별적 기술 경쟁력이 입증된 데 이어, 이번 IDE 승인을 통해 세계 최대 시장인 미국 진출 가능성을 더욱 높였다. 특히 미국 골대체재 시장은 연간 약 1조원 규모로, 이번 승인은 고부가가치 시장 진입의 실질적 출발점이라는 점에서도 의미가 크다.
본 제품은 시지바이오의 기존 대표 제품인 ‘노보시스(NOVOSIS)’를 기반으로 개발된 차세대 골대체재로, 구조적 안정성과 사용 편의성을 모두 갖춘 점이 특징이다.
기존 노보시스는 인체 뼈 구조를 모사한 하이드록시아파타이트(HA) 세라믹 지지체에 골형성 단백질(rhBMP-2)를 적용한 단일 구성 제품으로 넓은 영역에 사용이 유리한 제품이다. 반면 노보시스 퍼티는 성형성을 부여하는 미네랄 기반의 트리칼슘포스페이트(TCP)를 HA와 함께 적용한 이중 지지체 구조로, 성형 가능한 점성형(퍼티 제형)으로 설계되어 수술 부위에 맞춰 사용이 가능한 제품이다.
특히, 퍼티 제품은 시지바이오의 독자 기술인 서방형 제형 기술 ‘SLOREL™’을 적용해, 새로운 뼈 생성을 돕는 골형성 단백질(rhBMP-2)의 방출 속도와 효율을 더욱 정밀하게 조절할 수 있도록 했다.
이는 고밀도 골 형성을 유도하면서도, 원치 않는 부위에 뼈가 생기는 이상반응(이소성 뼈 생성) 위험은 낮추는 기술로 관련 효과는 이미 SCI급 국제학술지 ‘Journal of Clinical Medicine’에도 인체임상 결과가 발표돼 기술적 신뢰성을 확보했다.
골형성 단백질(rhBMP-2)은 대웅제약이 국산화 및 대량생산에 성공한 핵심 단백질 성분으로, 이번 FDA IDE 승인 과정에서도 제조공정 및 품질관리(CMC) 자료에 대한 정밀한 검토가 함께 이뤄졌다. 노보시스 퍼티는 의료기기로 분류되었지만, 심사 과정은 바이오의약품에 준하는 수준의 기준으로 진행됐다.
시지바이오는 대웅제약 관계사로서 연구개발, 생산, 품질 전반에 걸쳐 대웅제약과 긴밀한 협력 체계를 구축해 왔으며, 이번 IDE 심사 역시 이러한 공조를 바탕으로 철저히 대응해 승인에 이르렀다.
시지바이오는 현재 일본 파트너사인 니혼조끼를 통해 일본 현지에서 노보시스 퍼티 제품에 대한 허가용 임상시험을 진행하고 있으며, 최근 일본에서 임상 1/2상을 성공적으로 완료했다. 노보시스 퍼티는 미국을 포함한 선진국 시장을 타깃으로 개발된 제품으로, 이번 IDE 승인을 기점으로 유럽, 호주 등 주요 시장에 대한 허가 및 사업 확대도 본격화할 계획이다.
이번 허가를 총괄 담당한 한주미 시지바이오 미국법인 개발센터장은 “FDA가 요구하는 엄격한 기준을 충족해 확증임상 개시 승인을 받게 된 것은 시지바이오의 기술력과 품질 시스템이 글로벌 수준에 부합함을 보여주는 신호”라며 “이제부터는 가장 빠르게 우리 제품이 미국과 선진 글로벌 시장에 진입할 수 있도록 모든 역량을 다해 개발에 박차를 가하겠다”고 말했다.
유현승 시지바이오 대표는 “이번 IDE 승인 획득은 시지바이오가 수년간 축적해온 기술 기반 개발 전략의 중요한 결실”이라며 “특히 미국 내 바이오융복합 골대체재 시장은 진입장벽이 매우 높은 분야로, 이번 승인 자체가 시지바이오의 기술력과 노보시스 퍼티 제품 경쟁력을 국제적으로 다시 한 번 입증한 사례라고 생각한다. 시지바이오는 앞으로도 다양한 바이오융복합 의료기기 제품으로 환자 삶의 질을 높이는 혁신적 치료 옵션을 제공해 세계 의료기기 시장에서 의미 있는 변화를 이끌어가겠다”고 입장을 밝혔다. 장원수 기자
이번 승인으로 시지바이오는 미국 시판 허가(Premarket Approval, PMA)를 위한 마지막 임상 절차인 확증임상(Pivotal Study)을 본격적으로 돌입하게 됐으며, 미국 의료기기 시장 진출을 위한 실질적 단계를 개시하게 됐다.
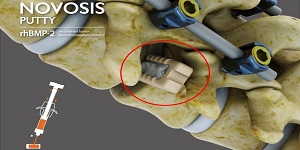
▲ 바이오 재생의료 전문기업 시지바이오는 자사 척추유합술용 차세대 골대체재 ‘노보시스 퍼티(NOVOSIS PUTTY)’가 지난 17일(미국 현지시각 16일) 미국 식품의약국(FDA)으로부터 IDE(임상시험계획 승인, Investigational Device Exemption)를 획득했다. <대웅>
특히 ‘노보시스 퍼티’는 한국에서 개발된 바이오융복합 의료기기 가운데 최초로 미국 식품의약국(FDA)으로부터 확증임상 승인을 받은 사례로, 시지바이오의 글로벌 진입 전략에 있어 중대한 이정표가 될 전망이다.
IDE 승인은 의료기기를 사람을 대상으로 시험하기에 앞서, 미국 내에서 FDA의 정식 허가를 받아야 하는 절차다. 특히 골대체재와 같은 이식형 의료기기의 경우 확증임상(Pivotal Study)은 시판 허가(PMA)를 위한 필수 단계로, 미국 시장 진입을 위한 가장 높은 진입장벽 중 하나로 꼽힌다.
시지바이오는 이번 IDE 승인을 위해 철저히 준비된 비임상 및 소규모 사전 인체임상(Pilot) 결과를 기반으로 제품의 기술력과 안전성에 대한 신뢰를 확보했으며, 이를 통해 FDA의 엄격한 검증 절차를 통과했다.
‘노보시스 퍼티’는 2023년 12월 FDA로부터 혁신의료기기(Breakthrough Device)로 지정되면서 이미 글로벌 수준의 차별적 기술 경쟁력이 입증된 데 이어, 이번 IDE 승인을 통해 세계 최대 시장인 미국 진출 가능성을 더욱 높였다. 특히 미국 골대체재 시장은 연간 약 1조원 규모로, 이번 승인은 고부가가치 시장 진입의 실질적 출발점이라는 점에서도 의미가 크다.
본 제품은 시지바이오의 기존 대표 제품인 ‘노보시스(NOVOSIS)’를 기반으로 개발된 차세대 골대체재로, 구조적 안정성과 사용 편의성을 모두 갖춘 점이 특징이다.
기존 노보시스는 인체 뼈 구조를 모사한 하이드록시아파타이트(HA) 세라믹 지지체에 골형성 단백질(rhBMP-2)를 적용한 단일 구성 제품으로 넓은 영역에 사용이 유리한 제품이다. 반면 노보시스 퍼티는 성형성을 부여하는 미네랄 기반의 트리칼슘포스페이트(TCP)를 HA와 함께 적용한 이중 지지체 구조로, 성형 가능한 점성형(퍼티 제형)으로 설계되어 수술 부위에 맞춰 사용이 가능한 제품이다.
특히, 퍼티 제품은 시지바이오의 독자 기술인 서방형 제형 기술 ‘SLOREL™’을 적용해, 새로운 뼈 생성을 돕는 골형성 단백질(rhBMP-2)의 방출 속도와 효율을 더욱 정밀하게 조절할 수 있도록 했다.
이는 고밀도 골 형성을 유도하면서도, 원치 않는 부위에 뼈가 생기는 이상반응(이소성 뼈 생성) 위험은 낮추는 기술로 관련 효과는 이미 SCI급 국제학술지 ‘Journal of Clinical Medicine’에도 인체임상 결과가 발표돼 기술적 신뢰성을 확보했다.
골형성 단백질(rhBMP-2)은 대웅제약이 국산화 및 대량생산에 성공한 핵심 단백질 성분으로, 이번 FDA IDE 승인 과정에서도 제조공정 및 품질관리(CMC) 자료에 대한 정밀한 검토가 함께 이뤄졌다. 노보시스 퍼티는 의료기기로 분류되었지만, 심사 과정은 바이오의약품에 준하는 수준의 기준으로 진행됐다.
시지바이오는 대웅제약 관계사로서 연구개발, 생산, 품질 전반에 걸쳐 대웅제약과 긴밀한 협력 체계를 구축해 왔으며, 이번 IDE 심사 역시 이러한 공조를 바탕으로 철저히 대응해 승인에 이르렀다.
시지바이오는 현재 일본 파트너사인 니혼조끼를 통해 일본 현지에서 노보시스 퍼티 제품에 대한 허가용 임상시험을 진행하고 있으며, 최근 일본에서 임상 1/2상을 성공적으로 완료했다. 노보시스 퍼티는 미국을 포함한 선진국 시장을 타깃으로 개발된 제품으로, 이번 IDE 승인을 기점으로 유럽, 호주 등 주요 시장에 대한 허가 및 사업 확대도 본격화할 계획이다.
이번 허가를 총괄 담당한 한주미 시지바이오 미국법인 개발센터장은 “FDA가 요구하는 엄격한 기준을 충족해 확증임상 개시 승인을 받게 된 것은 시지바이오의 기술력과 품질 시스템이 글로벌 수준에 부합함을 보여주는 신호”라며 “이제부터는 가장 빠르게 우리 제품이 미국과 선진 글로벌 시장에 진입할 수 있도록 모든 역량을 다해 개발에 박차를 가하겠다”고 말했다.
유현승 시지바이오 대표는 “이번 IDE 승인 획득은 시지바이오가 수년간 축적해온 기술 기반 개발 전략의 중요한 결실”이라며 “특히 미국 내 바이오융복합 골대체재 시장은 진입장벽이 매우 높은 분야로, 이번 승인 자체가 시지바이오의 기술력과 노보시스 퍼티 제품 경쟁력을 국제적으로 다시 한 번 입증한 사례라고 생각한다. 시지바이오는 앞으로도 다양한 바이오융복합 의료기기 제품으로 환자 삶의 질을 높이는 혁신적 치료 옵션을 제공해 세계 의료기기 시장에서 의미 있는 변화를 이끌어가겠다”고 입장을 밝혔다. 장원수 기자


![[코스피 5천 그늘①] 증시 활황에도 못 웃는 LG그룹, 구광모 '체질 개선'과 '밸류업'으로 저평가 끊나](https://businesspost.co.kr/news/photo/202602/20260209151542_142553.jpg)



![[코스피 5천 그늘②] 롯데그룹 주주 흥 돋는 카드 안 보인다, 신동빈 유통·화학 계열사 '시장 소외'에 속앓이](https://businesspost.co.kr/news/photo/202601/P_20260127151310_76677.jpg)




